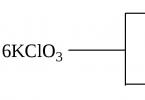معظم التفاعلات الكيميائية التي تحدث في العالم من حولنا وتستخدم في الصناعة معقدة. اعتمادا على الآلية، يتم تقسيمها إلى تفريغ,موازي,تسلسلي,المترافقة,سلسلة.
تشمل التفاعلات العكسية التفاعلات التي، في ظل ظروف معينة، يمكن أن تحدث تلقائيًا في كلا الاتجاهين الأمامي والخلفي. بشكل عام، يتم كتابة المعادلة الكيميائية للتفاعل العكسي على النحو التالي:
أأ + ب ب+ … ↔cC+dD+ …،
اين ا،ب، مع،د،…. - المعاملات المتكافئة أمام الصيغ الأولية (A، B، ....) والصيغ النهائية (C،د، ...) مواد.
مثال على عملية عكسية تحدث في الكائنات الحية هو رد فعل الأسترة:
R 1 – COOH + H O – R 2 ↔ R 1 – C(O)O – R 2 + H 2 O,
وتستخدم في الصناعة - تركيب الأمونيا من النيتروجين والهيدروجين:
3 ح 2 + ن 2 ↔ 2 نه 3
جمعدل التفاعل العكسي يساوي الفرق بين معدلات التفاعلات الأمامية والعكسية.
التفاعلات الموازية هي تفاعلات من الشكل:
أي، حيث تشكل نفس المواد الأولية، التي تتفاعل مع بعضها البعض في وقت واحد، منتجات مختلفة.
مثال على هذا النوع من التفاعل هو تفاعل تحلل ملح بيرثولت KClO 3، والذي يمكن أن يستمر تحت ظروف معينة في اتجاهين

بالتوازي، يمكن أن يحدث اضمحلال النوى الذرية لبعض العناصر المشعة من خلال آليتين أو أكثر. تحدث التفاعلات المتوازية بشكل خاص في الكيمياء العضوية. على سبيل المثال، عندما يتم سلفنة التولوين مع حمض الكبريتيك، يمكن أن تتشكل مشتقات أورثو وباراسولفو في وقت واحد:

وفي بعض الحالات، قد تكون التفاعلات الكيميائية الحيوية التي تحدث في خلايا الكائنات الحية متوازية أيضًا. على سبيل المثال، التخمر الأنزيمي للجلوكوز:
1) ج 6 ح 12 س 6  2ج2ح5أوه+2كو2
2ج2ح5أوه+2كو2
التخمر الكحولي
2) ج 6 ح 12 س 6  CH 3 – CH(OH) – COOH
CH 3 – CH(OH) – COOH
تخمير حمض اللبنيك
في ظل ظروف معينة، يمكن للعديد من التفاعلات المتوازية أن تتم في الغالب في اتجاه واحد فقط.
يتم تحديد سرعة التفاعل الموازي من خلال سرعة أسرع مراحله.
التفاعلات المتسلسلة هي تلك التي لا يتم فيها تكوين المنتج النهائي من المواد الأولية بشكل مباشر، ولكن بالضرورة من خلال سلسلة من المراحل الوسيطة، تحدث واحدة تلو الأخرى في تسلسل محدد بدقة.من الناحية التخطيطية، يمكن تصوير هذه العملية على النحو التالي:
أ → ب → ج → د،
حيث يشير كل حرف إلى مرحلة منفصلة من العملية. بشكل عام، يمكن أن يكون عدد هذه المراحل في ردود الفعل المتعاقبة مختلفا تماما (من عدة وحدات إلى عدة عشرات). علاوة على ذلك، فإن كل مرحلة من المراحل، بدورها، ليست بالضرورة تفاعلًا بسيطًا أحاديًا أو ثنائي الجزيئي، ولكنها يمكن أن تكون معقدة أيضًا.
التفاعلات المتسلسلة شائعة في الطبيعة، وغالبًا ما يتم ملاحظتها بشكل خاص في العمليات الكيميائية الحيوية التي تحدث في الكائنات الحية والنباتات. ومن أمثلة هذه التفاعلات عملية التمثيل الضوئي والأكسدة البيولوجية للجلوكوز، والتحلل المائي للسكريات والسكريات، وما إلى ذلك.
يعد حساب حركية التفاعلات المتسلسلة أمرًا معقدًا ويمكن إجراؤه بدقة تامة فقط لعمليات بسيطة نسبيًا تتكون من عدد صغير من المراحل.
ومع ذلك، إذا كانت إحدى مراحل التفاعل المتسلسل لها سرعة أقل بكثير من جميع المراحل الأخرى، فسيتم تحديد معدل التفاعل الإجمالي من خلال سرعة هذه المرحلة المحددة، والتي تسمى في هذه الحالةالحد.
على سبيل المثال، تفاعل الكلورة لأكسيد النيتريك (II)
2NO+Cl 2 = 2NOCl
يتكون من مرحلتين:
1) NO + Cl 2 = NOCl 2؛
2) NOCl 2 + NO = 2NOCl
تبدأ المرحلة الأولى بسرعة بتكوين المنتج غير المستقر NOCl 2. المرحلة الثانية بطيئة ومحدودة. يتم وصف معدل التفاعل بأكمله بالمعادلة الحركية
= ك  · ج لا
· ج لا
والترتيب العام لهذا التفاعل هو 2.
تسمى التفاعلات التي تتم وفقًا للمخطط التالي بالتفاعلات المترافقة:
يمكن أن يحدث أحد هذه التفاعلات بشكل مستقل، ويكون التفاعل الثاني ممكنًا فقط في وجود الأول. وبالتالي، فإن حدوث رد فعل واحد يبدأ في تنفيذ الثاني.
التفاعلات المترافقة ممكنة في الكيمياء الحيوية. تحدث في الخلايا، ويتم توفير الطاقة اللازمة للتفاعل الثاني مع ΔG 2 > 0 من خلال التفاعل الأول، حيث ΔG 1< 0. Причём │ΔG 1 │>│ΔG 2 │، أي. تستمر العملية برمتها مع انخفاض طاقة جيبس. وتسمى هذه التفاعلات الكيميائية الحيوية بخلاف ذلك بالتزامن.
غالبًا ما تتكون آلية التفاعلات المترافقة من تكوين جزيئات وسيطة نشطة (جذور أو أيونات) في المرحلة الأولى، والتي تبدأ حدوث جميع التفاعلات الأخرى.
يمكن تمثيل مخطط التفاعلات المترافقة من هذا النوع بشكل عام على النحو التالي:

حيث C هو الجسيم الوسيط النشط.
على سبيل المثال، لا يتأكسد البنزين الموجود في محلول مائي بواسطة H2O2، ولكن عند إضافة ملح الحديد ثنائي التكافؤ، فإنه يتحول إلى الفينول وثنائي الفينيل. "لبدء هذه العملية، تتفاعل أيونات Fe 2+ أولاً مع H 2 O 2، لتشكل الجذور OH
الحديد 2+ + ح 2 يا 2 → الحديد 3+ + أوه - + ˙ أوه،
والتي تتفاعل بعد ذلك كما هو الحال مع البنزين
ج6 ح6+ ˙ أوه → ˙ ج6 ح5 + ح2س
˙ ج6 ح5+ ˙ أوه → ج 6 ح 5 أوه
الشيء نفسه مع الحديد 2+
الحديد 2+ + ˙ أوه → الحديد 3+ + أوه –
تمت دراسة ظاهرة الحث الكيميائي لأول مرة بواسطة N.A. شيلوف في عام 1905
التفاعلات المتسلسلة هي تفاعلات كيميائية تتم عبر سلسلة من المراحل الأولية المتكررة بانتظام بمشاركة جزيئات نشطة تحتوي على ذرات ذات إلكترونات غير متزاوجة على مستوى الطاقة الخارجي (أو بمعنى آخر الجذور الحرة).
تشمل التفاعلات المتسلسلة الاحتراق والبلمرة والتكثيف المتعدد والتحلل النووي وما إلى ذلك.
آلية التفاعلات المتسلسلة هي أن الجذور الحرة (ذرات مفردة غالبًا) لها نشاط كيميائي مرتفع. فهي تتفاعل بسهولة مع الجزيئات المستقرة وتحولها إلى جزيئات نشطة، والتي تشكل بعد ذلك منتجات التفاعل وجذور جديدة، وبالتالي تنشأ سلسلة من المراحل الإضافية. ويستمر التفاعل المتسلسل حتى تتفاعل المادة بأكملها، أو حتى تختفي الجزيئات الجذرية النشطة.
تتميز التفاعلات المتسلسلة بثلاث مراحل: 1) بدء السلسلة; 2)تطوير السلسلة أو النمو; 3)دائرة مفتوحة.
يبدأ بدء السلسلة بفعل كيميائي أولي، ونتيجة لذلك يتم تشكيل جسيم نشط. تتطلب هذه العملية طاقة ويمكن أن تحدث عن طريق تسخين المادة، أو التعرض للإشعاع المؤين، أو عمل المحفز.
على سبيل المثال، في تفاعل تخليق كلوريد الهيدروجين والهيدروجين والكلور، والذي يحدث وفقًا لآلية السلسلة (H 2 + Cl 2 = 2HCl)، يتوافق تكوين السلسلة مع العملية
Cl2  2 ∙
Cl
2 ∙
Cl
تطوير السلسلة هو تكرار دوري لخطوات التفاعل التي تتضمن الجذور الناتجة. وتسمى أيضًا روابط السلسلة:
ح 2 + · الكلور → حمض الهيدروكلوريك + ˙ ح
˙ ح+كل 2 →حمض الهيدروكلوريك+ ˙ Cl
ح2+ ˙ الكلور → حمض الهيدروكلوريك + ˙ ح
Cl2+ ˙ ح → حمض الهيدروكلوريك + ˙ كلي الخ.
يتم تحديد طول السلسلة من خلال عدد جزيئات المادة الأولية التي تفاعلت نتيجة فعل واحد من نواة السلسلة قبل أن تنكسر.
حسب خصائص مرحلة التطور تنقسم التفاعلات المتسلسلة إلى غير متفرعو متفرعة. في الحالة الأولى، يبقى عدد جزيئات الجذور الحرة النشطة دون تغيير طوال هذه المرحلة بأكملها.
في ردود الفعل المتفرعة يؤدي استهلاك جسيم نشط واحد إلى تكوين عدة (اثنين أو أكثر) من الجسيمات النشطة الأخرى. من الناحية التخطيطية، يمكن تمثيل ذلك على النحو التالي:

يتوافق انتهاء السلسلة مع اختفاء الجزيئات النشطة نتيجة تفاعلها مع بعضها البعض:
˙ ح+ ˙ ح = ح2
˙ الكلور + ˙ Cl=Cl2 دائرة مفتوحة
˙ ح+ ˙ الكلورين = حمض الهيدروكلوريك
بالإضافة إلى ذلك، يمكن أن يحدث أثناء امتزاز الجسيمات بواسطة جدران الوعاء، عندما يصطدم جسيمان نشطان مع جسيم ثالث (يسمى المانع)، حيث تعطي الجسيمات النشطة طاقة زائدة. ولذلك تتميز التفاعلات المتسلسلة باعتماد سرعتها على حجم وعاء التفاعل وشكله ومادته، وعلى وجود مواد غريبة خاملة تعمل كمثبط.
يتم تحديد سرعة التفاعلات المتسلسلة غير المتفرعة من خلال سرعة المرحلة الأبطأ، أي. أصل السلسلة. وفي كل مرحلة من التفاعلات من هذا النوع تستخدم المعادلات المعتادة للحركية الكيميائية (الدرجة الأولى أو الثانية).
يمكن أن تتم التفاعلات الكيميائية المتفرعة وفقًا لقانون حركي معقد وليس لها ترتيب محدد. غالبًا ما يؤدي "تكاثر" المتطرفين فيها إلى عملية تشبه الانهيار الجليدي، مما يؤدي إلى انفجار. ومع ذلك، إنهاء السلسلة ممكن أيضًا في هذه التفاعلات. ولذلك تحدث زيادة سريعة في سرعة العملية (تصل إلى الانفجار) إذا تجاوز معدل تفرع السلسلة معدل كسرها. تم تطوير نظرية التفاعلات المتسلسلة في أعمال الأكاديمي ن.ن. سيمينوفا، إس.إن. هينشلوود (إنجلترا) وعلماء آخرون.
هناك تفاعلات متسلسلة لا تكون فيها الجزيئات النشطة جذرية، بل أيونات تتشكل نتيجة للانقسام المغاير للرابطة الكيميائية:
أ : ب → أ ˉ : +ب+
غالبًا ما يتم تحقيق آلية مماثلة في الممارسة العملية في تفاعلات البلمرة للمركبات العضوية غير المشبعة.
وتنقسم جميع المواد إلى بسيطة ومعقدة.
مواد بسيطة- وهي المواد التي تتكون من ذرات عنصر واحد.
في بعض المواد البسيطة، تتحد ذرات العنصر نفسه مع بعضها البعض لتكوين جزيئات. مثل هذه المواد البسيطة لها التركيب الجزيئي. وتشمل هذه: ، . كل هذه المواد تتكون من جزيئات ثنائية الذرة. (لاحظ أن أسماء المواد البسيطة هي نفس أسماء العناصر!)
هناك مواد بسيطة أخرى التركيب الذريأي أنها تتكون من ذرات تربط بينها روابط معينة. ومن أمثلة هذه المواد البسيطة الكل (، وما إلى ذلك) وبعضها (، وما إلى ذلك). ليس فقط الأسماء، ولكن أيضًا صيغ هذه المواد البسيطة تتطابق مع رموز العناصر.
كما أن هناك مجموعة من المواد البسيطة تسمى . وتشمل هذه: الهيليوم He، النيون Ne، الأرجون Ar، الكريبتون Kr، زينون Xe، الرادون Rn. تتكون هذه المواد البسيطة من ذرات غير مرتبطة ببعضها البعض.
يشكل كل عنصر مادة بسيطة واحدة على الأقل. يمكن لبعض العناصر أن تشكل مادتين بسيطتين أو أكثر. وتسمى هذه الظاهرة التآصل.
التآصلهي ظاهرة تكوين عدة مواد بسيطة بواسطة عنصر واحد.
تسمى المواد البسيطة المختلفة التي يتكونها نفس العنصر الكيميائي بالتعديلات المتآصلة.
قد تختلف التعديلات المتآصلة عن بعضها البعض في التركيب الجزيئي. على سبيل المثال، يشكل عنصر الأكسجين مادتين بسيطتين. واحد منهم يتكون من جزيئات ثنائية الذرة O 2 ولها نفس اسم العنصر-. مادة أخرى بسيطة تتكون من جزيئات ثلاثية الذرات O 3 ولها اسمها الخاص - الأوزون.
الأكسجين O 2 والأوزون O 3 لهما خصائص فيزيائية وكيميائية مختلفة.
يمكن أن تكون التعديلات المتآصلة عبارة عن مواد صلبة لها هياكل بلورية مختلفة. ومن الأمثلة على ذلك التعديلات المتآصلة للكربون C - الماس والجرافيت.
عدد المواد البسيطة المعروفة (حوالي 400) أكبر بكثير من عدد العناصر الكيميائية، حيث أن العديد من العناصر يمكن أن تشكل تعديلين أو أكثر من التعديلات المتآصلة.
المواد المعقدة- وهي المواد التي تتكون من ذرات عناصر مختلفة.
أمثلة على المواد المعقدة: حمض الهيدروكلوريك، H2O، NaCl، CO2، H2SO4، إلخ.
غالبًا ما تسمى المواد المعقدة بالمركبات الكيميائية. وفي المركبات الكيميائية لا يتم الحفاظ على خواص المواد البسيطة التي تتكون منها هذه المركبات. تختلف خصائص المادة المعقدة عن خصائص المواد البسيطة التي تتكون منها.
على سبيل المثال، يمكن تشكيل كلوريد الصوديوم NaCl من مواد بسيطة - الصوديوم المعدني Na والكلور الغازي Cl. تختلف الخواص الفيزيائية والكيميائية لـ NaCl عن خواص Na وCl2.
في الطبيعة، كقاعدة عامة، لا توجد مواد نقية، ولكن مخاليط المواد. وفي الأنشطة العملية، نستخدم عادةً أيضًا خليطًا من المواد. أي خليط يتكون من مادتين أو أكثر تسمى مكونات الخليط.
على سبيل المثال، الهواء عبارة عن خليط من عدة مواد غازية: الأكسجين O 2 (21٪ من حيث الحجم)، (78٪)، إلخ. المخاليط عبارة عن محاليل للعديد من المواد وسبائك بعض المعادن وما إلى ذلك.
مخاليط المواد متجانسة (متجانسة) وغير متجانسة (غير متجانسة).
مخاليط متجانسة- هذه مخاليط لا يوجد فيها واجهة بين المكونات.
تكون مخاليط الغازات (خاصة الهواء) والمحاليل السائلة (مثل محلول السكر في الماء) متجانسة.
مخاليط غير متجانسة- وهي مخاليط يتم فيها الفصل بين مكوناتها بواسطة واجهة.
تشمل المخاليط غير المتجانسة مخاليط المواد الصلبة (الرمل + مسحوق الطباشير)، ومخاليط السوائل غير القابلة للذوبان في بعضها البعض (ماء + زيت)، ومخاليط السوائل والمواد الصلبة غير القابلة للذوبان فيه (ماء + طباشير).
أهم الفروق بين المخاليط والمركبات الكيميائية:
- في المخاليط، يتم الحفاظ على خصائص المواد الفردية (المكونات).
- تكوين المخاليط ليس ثابتا.
قام فريق دولي من العلماء بتصنيع ودراسة سيبورجيوم هيكساكربونيل، Sg(CO)6، وهو مركب من العنصر غير المستقر ذو العدد الذري 106 مع أول أكسيد الكربون، ومقارنته أيضًا بمركبات مماثلة من نظائر الموليبدينوم والتنغستن غير المستقرة، وهي متجانسات السيبورجيوم. . هذا هو المركب الكيميائي الأكثر تعقيدًا الذي تم الحصول عليه تجريبيًا، والذي يتضمن ترانساكتينويد، أي عنصر ذو رقم ذري أعلى من 103. في الخواص الكيميائية للترانساكتينويدات، تكون تأثيرات النظرية النسبية للإلكترونات الداخلية أكثر وضوحًا، وبالتالي فإن تتيح دراسة كيمياء الترانساكتينويدات توضيح النظرية الكاملة لحساب التركيب الإلكتروني للذرات الثقيلة.
الجدول الدوري للعناصر الكيميائية ممتلئ بالفعل حتى الرقم 118 (الشكل 1). يعكس هيكلها بأكمله دورية الخواص الكيميائية للعناصر ذات العدد الذري المتزايد، والتي تنشأ مع الملء التدريجي للأصداف الإلكترونية. إذا كان عنصران كيميائيان يختلفان في عدد أغلفة الإلكترونات الداخلية المملوءة بالكامل، لكن لهما إلكترونات خارجية متشابهة - وهي المسؤولة عن الروابط الكيميائية - فيجب أن يكون للعنصرين خصائص كيميائية مماثلة. تسمى هذه السلسلة من العناصر متجانسات بعضها البعض، وفي الجدول الدوري تقع في نفس المجموعة، واحدة فوق الأخرى. على سبيل المثال، المعادن الانتقالية التي تشكل المجموعة السادسة - الكروم والموليبدينوم والتنغستن والعنصر فائق الثقل رقم 106 السيبورجيوم - هي متجانسة مع بعضها البعض. في حين أن الخصائص الكيميائية للثلاثة الأولى منها معروفة منذ فترة طويلة، إلا أن كيمياء السيبورجيوم قد بدأت للتو في الدراسة. ومع ذلك، بناءً على الجدول الدوري، من المتوقع أن تكون خواصها الكيميائية متشابهة.
عند مقارنة الخواص الكيميائية للعناصر المتماثلة، هناك مأزق واحد مهم. في الذرات الثقيلة، تتحرك الإلكترونات الداخلية بسرعات قريبة من سرعة الضوء، ولهذا السبب فإن تأثيرات النظرية النسبية تعمل على أكمل وجه. إنها تؤدي إلى ضغط إضافي للمدارات s و p، ونتيجة لذلك، إلى بعض التوسع في السحب الإلكترونية الخارجية. تعمل الشحنة النووية الكبيرة أيضًا على تعزيز تأثيرات تفاعل الإلكترونات مع بعضها البعض، مثل تقسيم المدار المغزلي. كل هذا يؤثر على الرابطة الكيميائية للذرة الثقيلة مع جيران معينين. ويجب أن تكون الكيمياء النظرية الحديثة قادرة على حساب كل هذه التأثيرات بشكل صحيح.
كلما كانت الذرة أثقل، كانت التأثيرات النسبية أقوى. ويبدو من الطبيعي استخدام أثقل العناصر المعروفة، وهي العناصر التي يزيد عددها الذري عن 103، لاختبار الحسابات النظرية (الشكل 1). ومع ذلك، تنشأ العديد من الصعوبات الهامة في طريقهم إلى دراستهم التجريبية.
أولاً، النوى الذرية للعناصر الترانساكتينويدية غير مستقرة للغاية؛ حياتهم النموذجية هي دقائق أو ثواني أو حتى أجزاء من الثانية. ولذلك، لا يوجد حديث عن أي تراكم لكمية عيانية من المادة، وعلينا أن نعمل مع الذرات الفردية مباشرة بعد ولادتها.
لن تكون هذه مشكلة كبيرة لولا الصعوبة الثانية: لا يمكن الحصول على هذه الذرات إلا من خلالها كميات قطعة. يتم تصنيع الذرات فائقة الثقل في التفاعلات النووية، من خلال دمج ذرتين ثقيلتين إلى حد ما مع نسبة عالية من النيوترونات. وللقيام بذلك يتم توجيه شعاع من الأيونات الثقيلة من نوع ما نحو هدف يحتوي على ذرات ثقيلة من نوع آخر، وعندما تصطدم بينهما تحدث تفاعلات نووية. وفي الغالبية العظمى من الحالات، فإنها لا تولد سوى شظايا أصغر، وفي بعض الأحيان فقط يحدث أن تولد النواة فائقة الثقل المرغوبة من اندماج نواتين. ونتيجة لذلك، فإن معدل إنتاج النوى فائقة الثقل أثناء التشعيع المستمر للهدف يتبين أنه منخفض بشكل يبعث على السخرية: بمعدل نواة واحدة في الدقيقة، أو في الساعة، أو في اليوم، أو حتى في الأسبوع.
تؤدي تقنية الولادة هذه إلى مشكلة ثالثة. يحدث تخليق الذرات فائقة الثقل في ظل ظروف الإشعاع القاسي المستمر من شعاع يضرب الهدف، ونتيجة لذلك، في ظل وجود تدفق ضخم من الحطام النووي الدخيل. حتى لو ولدت النواة المرغوبة، وتأخذ إلكترونات من البيئة، وتصبح ذرة حقيقية، وأخيرًا، مباشرة خلف الهدف تدخل في تفاعل كيميائي لتكوين مركب جديد - سيكون هذا المركب في ظروف إشعاع قاسية، وفي اتصال دائم مع البلازما الناجمة عن التأين الصعب إن حقيقة أنه في ظل هذه الظروف من الممكن عمومًا دراسة نوع ما من كيمياء الترانساكتينويدات حتى الفليروفيوم (العنصر 114) يعد في حد ذاته إنجازًا عظيمًا. ومع ذلك، حتى الآن، كانت جميع المركبات الكيميائية التي تحتوي على ترانساكتينويدات بسيطة جدًا من وجهة نظر كيميائية - الهاليدات والأكاسيد والمركبات المماثلة الأخرى ذات الذرة الثقيلة في حالة الأكسدة القصوى. يتم تدمير المركبات الكيميائية الأكثر هشاشة ذات الروابط الكيميائية غير التافهة بسرعة في وجود إشعاعات قاسية. وكل هذا، للأسف، يجعل من الصعب اختبار الخواص الكيميائية للترانساكتينويدات.
في ذلك اليوم في مجلة علومتم نشره، إيذانًا ببداية كيمياء المعاملات "غير التافهة". ويورد التقرير التوليف والدراسة التجريبية للمركب Sg(CO) 6، سيبورجيوم هيكساكربونيل (الشكل 2). علاوة على ذلك، في نفس الإعداد وبنفس الطرق، تمت أيضًا دراسة معقدات السداسي كربونيل من العناصر المتماثلة السيبورجيوم، Mo(CO) 6 وW(CO) 6، كما تم دراسة نظائر الموليبدينوم والتنغستن قصيرة العمر بعمر نصف قدره عدة ثوان أو دقائق.
أهم ما يميز هذا العمل هو الإعداد التجريبي المدمج الذي يجمع العديد من التطورات التقنية في العقد الماضي. يتغلب هذا التثبيت على المشكلة الثالثة المذكورة أعلاه - فهو يفصل مكانيًا بين منطقة تخليق النوى فائقة الثقل ومنطقة البحث الفيزيائي والكيميائي للمركب الناتج. ويظهر مظهرها العام في الشكل. 3. عند مدخل التثبيت (من اليمين إلى اليسار في خلفية الشكل)، يتفاعل شعاع من النوى مع الهدف ويولد "كوكتيلاً" من النوى الثانوية. تنحرف منتجات التفاعل بواسطة مجال مغناطيسي ثنائي القطب (العنصر D في الشكل)، وبطرق مختلفة بنسب مختلفة من الشحنة وكتلة النوى. يتم حساب حجم المجال المغناطيسي بطريقة بحيث تمر النوى قيد الدراسة فقط عبر نظام العدسات المغناطيسية (Q)، بينما تنحرف نوى الخلفية والشعاع الأصلي بعيدًا. في جوهرها، تكرر هذه التقنية قياس الطيف الكتلي المعروف المطبق على النوى.
في الخطوة التالية، تدخل النوى المنفصلة (Sg، Mo أو W) إلى غرفة RTC، والتي يتم من خلالها نفخ خليط غاز الهيليوم وأول أكسيد الكربون. نقطة مهمة: في الطريق إلى الغرفة، تمر النوى عبر نافذة ذات سماكة محددة بدقة، مصنوعة من مادة مايلر. إنه يثبط الطاقة الحركية للنوى الساخنة ويسمح لها بالتسخين (إبطاء طاقة الحركة الحرارية للجزيئات) داخل غرفة الغاز. هناك النوى "مرتدية بالإلكترونات" وتدخل في تفاعل كيميائي مع أول أكسيد الكربون وتشكل مركبًا - مركب الكربونيل. نظرًا لأن المركب متطاير، فإنه يتم نقله مع تدفق الغاز بالكامل من خلال أنبوب تفلون بطول 10 أمتار إلى الجزء الثاني من التثبيت - وهو محلل مدمج خاص.
يرمز الاسم COMPACT إلى جهاز كشف متعدد عبر الإنترنت للفيزياء والكيمياء للترانساكتينويدات. هذا التثبيت عبارة عن خط كامل مكون من 32 زوجًا من أجهزة كشف أشباه الموصلات للتحليل اللوني الحراري للغاز لمركبات العناصر غير المستقرة. يتم إنشاء تدرج قوي في درجة الحرارة على طول الخط: كل زوج من أجهزة الكشف يكون في درجة حرارته الخاصة، من +30 درجة مئوية في بداية الخط إلى -120 درجة مئوية في نهايته. وكل كاشف قادر على تسجيل جسيمات ألفا وبيتا المنبعثة من النوى أثناء اضمحلالها، وقياس طاقتها وزمن انطلاقها بدقة عالية. وهذا ضروري من أجل التعرف على نوى السيبورجيوم من خلال سلسلة اضمحلالها المميزة، والتي تنبعث فيها جسيمات ألفا ذات طاقات معينة واحدة تلو الأخرى، وعدم الخلط بين هذه الأحداث النادرة والعمليات الخلفية.
يعمل محلل COMPACT بهذه الطريقة. عندما يتم نفخ خليط الغاز عبر المسطرة، تترسب جزيئات مركب الكربونيل من المعدن الثقيل على سطح كاشف معين، حيث يتم تسجيلها بعد الاضمحلال الإشعاعي. يشير رقم الكاشف الذي تم تسجيل الاضمحلال فيه إلى درجة الحرارة التي يصبح عندها امتصاص الجزيء مناسبًا للطاقة. يتم تحديد درجة الحرارة هذه من خلال الخصائص الفيزيائية والكيميائية لمركب الكربونيل قيد الدراسة - المحتوى الحراري للامتزاز. حسنًا، هذه الخاصية المميزة للمادة بدورها يتم التنبؤ بها من خلال الحسابات الكيميائية، حيث تلعب التأثيرات النسبية دورًا مهمًا. وبالتالي، من خلال قياس كيفية ترسب Sg(CO) 6 وW(CO) 6 وMo(CO) 6 في محلل COMPACT، يمكن التحقق من الحسابات النظرية الكيميائية ويمكن قياس المحتوى الحراري لامتصاص هذه الأنواع.

وتظهر نتائج هذه الدراسة في الشكل. 4. فيما يلي العديد من الخصائص في كل زوج من أجهزة الكشف البالغ عددها 32 زوجًا. الرسم البياني العلوي هو ببساطة توزيع درجة الحرارة على طول المسطرة. تُظهر الرسوم البيانية الوسطى والسفلية، في الواقع، البيانات التجريبية نفسها - توزيع التحلل المسجل لنواة التنغستن -164 (في المركز) ونواة السيبورجيوم -265 (في الأسفل) عبر أجهزة الكشف. لا يوجد، بالطبع، أحداث كافية مع Seaborgium هنا - خلال أسبوعين من التشعيع المستمر للهدف بحزمة مكثفة، تم تسجيل ما مجموعه 18 منها. ولكن مع ذلك، فمن الواضح أنها ليست موزعة بالتساوي على طول الخط، ولكن أقرب إلى نهايته، في أجهزة الكشف ذات الأرقام فوق 20. تم الحصول على نفس الصورة تقريبًا عند نمذجة هذه العملية باستخدام المحتوى الحراري للامتزاز، الذي تم حسابه مؤخرًا في عمل نظري فقط لهذه المواد. ولوحظت صورة مماثلة للمركبات ذات نظائر التنغستن غير المستقرة ونظائر الموليبدينوم (لا تظهر في الشكل): الحد الأقصى للتوزيعات يقع بالضبط حيث تتنبأ الحسابات النظرية. تعطي هذه المصادفة ثقة إضافية بأن الأساليب الحديثة للحساب النسبي الكامل لبنية الذرات الثقيلة تصف البيانات التجريبية بشكل مناسب.
وأخيرا، من المفيد أن نلقي نظرة شاملة على هذا البحث. عادةً ما تكون العناصر فائقة الثقل غير المستقرة محل اهتمام الفيزيائيين من أجل معرفة جديدة في الفيزياء النووية. ومع ذلك، بما أن الطبيعة تسمح لنا بذلك، فيمكن استخدام هذه العناصر لغرض آخر، وهو اختبار مدى قدرتنا على التنبؤ المواد الكيميائيةخصائص هذه الذرات. وهذه المعرفة، بدورها، لا نحتاجها في حد ذاتها، ولكن كاختبار إضافي لكامل النظرية الحديثة لحساب الهياكل الإلكترونية للذرات الثقيلة، مع مراعاة التأثيرات النسبية. ومن هنا تأتي العديد من التطبيقات، بدءًا من الأبحاث التطبيقية البحتة وحتى العلوم الأساسية الحقيقية. تؤكد كيمياء الترانساكتينويدات مرة أخرى على مدى قوة الترابط بين مجالات الفيزياء الأكثر تنوعًا والتخصصات ذات الصلة.