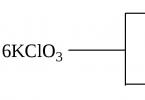Die meisten chemischen Reaktionen, die in der Welt um uns herum ablaufen und in der Industrie eingesetzt werden, sind komplex. Je nach Mechanismus werden sie unterteilt in reversibel,parallel,sequentiell,konjugieren,Kette.
Zu den reversiblen Reaktionen gehören Reaktionen, die unter bestimmten Bedingungen spontan sowohl in Vorwärts- als auch in Rückwärtsrichtung ablaufen können. Im Allgemeinen lautet die chemische Gleichung einer reversiblen Reaktion wie folgt:
aA + bB+ … ↔cC+dD+ …,
wo ein,B, Mit,D,…. – stöchiometrische Koeffizienten vor den Anfangs- (A, B, ...) und Endformeln (C,D, ...) Substanzen.
Ein Beispiel für einen reversiblen Prozess, der in lebenden Organismen abläuft, ist die Veresterungsreaktion:
R 1 – COOH + HO – R 2 ↔ R 1 – C(O)O – R 2 + H 2 O,
und in der Industrie eingesetzt - die Synthese von Ammoniak aus Stickstoff und Wasserstoff:
3 H 2 +N 2 ↔ 2NH 3
CDie Geschwindigkeit einer reversiblen Reaktion ist gleich der Differenz zwischen den Geschwindigkeiten der Hin- und Rückreaktion.
Parallelreaktionen sind Reaktionen der Form:
d. h. bei dem dieselben Ausgangsstoffe gleichzeitig miteinander reagieren und unterschiedliche Produkte bilden.
Ein Beispiel für diese Art von Reaktion ist die Zersetzungsreaktion des Berthollet-Salzes KClO 3, die unter bestimmten Bedingungen in zwei Richtungen ablaufen kann

Parallel dazu kann der Zerfall der Atomkerne einiger radioaktiver Elemente durch zwei oder mehr Mechanismen erfolgen. Besonders häufig kommen Parallelreaktionen in der organischen Chemie vor. Wenn beispielsweise Toluol mit Schwefelsäure sulfoniert wird, können gleichzeitig Ortho- und Parasulfo-Derivate entstehen:

In manchen Fällen können auch biochemische Reaktionen in den Zellen lebender Organismen parallel ablaufen. Zum Beispiel enzymatische Fermentation von Glukose:
1) C 6 H 12 O 6  2 C 2 H 5 OH+ 2CO 2
2 C 2 H 5 OH+ 2CO 2
alkoholische Gärung
2) C 6 H 12 O 6  СH 3 – CH(OH) – COOH
СH 3 – CH(OH) – COOH
Milchsäuregärung
Unter bestimmten Bedingungen können viele parallele Reaktionen überwiegend nur in eine Richtung ablaufen.
Die Geschwindigkeit einer Parallelreaktion wird durch die Geschwindigkeit ihrer schnellsten Stufe bestimmt.
Bei sequentiellen Reaktionen erfolgt die Bildung des Endprodukts aus den Ausgangsstoffen nicht direkt, sondern notwendigerweise über eine Reihe von Zwischenstufen, die nacheinander in einer genau definierten Reihenfolge ablaufen. Schematisch lässt sich dieser Vorgang wie folgt darstellen:
A → B → C → D,
wobei jeder Buchstabe eine separate Phase des Prozesses bezeichnet. Im Allgemeinen kann die Anzahl solcher Stufen in aufeinanderfolgenden Reaktionen sehr unterschiedlich sein (von mehreren Einheiten bis zu mehreren Dutzend). Darüber hinaus ist jeder der Schritte wiederum nicht unbedingt eine einfache mono- oder bimolekulare Reaktion, sondern kann auch komplex sein.
Sequentielle Reaktionen kommen in der Natur häufig vor und werden besonders häufig bei biochemischen Prozessen in lebenden Organismen und Pflanzen beobachtet. Beispiele für solche Reaktionen sind die Photosynthese und die biologische Oxidation von Glucose, die Hydrolyse von Oligo- und Polysacchariden usw.
Die Berechnung der Kinetik aufeinanderfolgender Reaktionen ist komplex und kann nur für relativ einfache Prozesse, die aus wenigen Stufen bestehen, recht genau durchgeführt werden.
Wenn jedoch eine der Stufen einer sequentiellen Reaktion eine deutlich geringere Geschwindigkeit als alle anderen aufweist, wird die Gesamtreaktionsgeschwindigkeit durch die Geschwindigkeit dieser bestimmten Stufe bestimmt, die in diesem Fall aufgerufen wirdeinschränkend.
Zum Beispiel die Chlorierungsreaktion von Stickoxid (II)
2NO+Cl 2 = 2NOCl
besteht aus zwei Phasen:
1) NO + Cl 2 = NOCl 2;
2) NOCl 2 + NO = 2NOCl
Die erste Stufe verläuft schnell mit der Bildung des instabilen Produkts NOCl 2. Die zweite Stufe ist langsam und einschränkend. Die Geschwindigkeit der gesamten Reaktion wird durch die kinetische Gleichung beschrieben
= k  ·C NR
·C NR
und die Gesamtordnung dieser Reaktion ist 2.
Reaktionen, die nach folgendem Schema ablaufen, heißen konjugiert:
Eine dieser Reaktionen kann unabhängig voneinander ablaufen und die zweite Reaktion ist nur in Gegenwart der ersten möglich. Somit löst das Auftreten einer Reaktion die Umsetzung der zweiten aus.
Konjugatreaktionen sind in der Biochemie möglich. Sie kommen in Zellen vor und die für die zweite Reaktion mit ΔG 2 > 0 benötigte Energie wird von der ersten Reaktion geliefert, für die ΔG 1 gilt< 0. Причём │ΔG 1 │>│ΔG 2 │, d.h. Der gesamte Prozess verläuft insgesamt mit einer Abnahme der Gibbs-Energie. Solche biochemischen Reaktionen werden auch anders genannt Tandem.
Der Mechanismus konjugierter Reaktionen besteht häufig in der Bildung aktiver Zwischenpartikel (Radikale oder Ionen) in der ersten Stufe, die den Ablauf aller anderen Reaktionen auslösen.
Das Schema konjugierter Reaktionen dieser Art lässt sich allgemein wie folgt darstellen:

wobei C das aktive Zwischenteilchen ist.
Beispielsweise wird Benzol in einer wässrigen Lösung nicht durch H 2 O 2 oxidiert, aber bei Zugabe eines zweiwertigen Eisensalzes wird es in Phenol und Biphenyl umgewandelt. Um „diesen Prozess zu starten, interagieren Fe 2+-Ionen zunächst mit H 2 O 2 und bilden OH-Radikale.“
Fe 2+ + H 2 O 2 → Fe 3+ + OH – + ˙ OH,
die dann wie mit Benzol reagieren
C 6 H 6 + ˙ OH → ˙ C 6 H 5 + H 2 O
˙ C 6 H 5 + ˙ OH → C 6 H 5 OH
Gleiches gilt für Fe 2+
Fe 2+ + ˙ OH→Fe 3+ +OH –
Das Phänomen der chemischen Induktion wurde erstmals von N.A. untersucht. Shilov im Jahr 1905
Kettenreaktionen sind chemische Reaktionen, die eine Reihe sich regelmäßig wiederholender Elementarstufen durchlaufen, an denen aktive Teilchen beteiligt sind, die Atome mit ungepaarten Elektronen auf der externen Energieebene (oder mit anderen Worten freie Radikale) enthalten.
Zu den Kettenreaktionen gehören Verbrennung, Polymerisation und Polykondensation, Kernzerfall usw.
Der Mechanismus von Kettenreaktionen besteht darin, dass freie Radikale (häufig einzelne Atome) eine hohe chemische Aktivität aufweisen. Sie interagieren leicht mit stabilen Molekülen und verwandeln diese in aktive Partikel, die dann Reaktionsprodukte und neue Radikale bilden und so eine Kette weiterer Stufen entsteht. Die Kettenreaktion setzt sich fort, bis die gesamte Substanz reagiert oder bis die aktiven Radikalpartikel verschwinden.
Kettenreaktionen sind durch drei Phasen gekennzeichnet: 1) Ketteninitiierung; 2)Kettenentwicklung oder -wachstum; 3)offener Kreislauf.
Die Initiierung einer Kette beginnt mit einem elementaren chemischen Vorgang, durch den ein aktives Teilchen entsteht. Dieser Prozess erfordert Energie und kann durch Erhitzen der Substanz, Einwirkung ionisierender Strahlung oder die Einwirkung eines Katalysators erfolgen.
Beispielsweise entspricht bei der Reaktion der Synthese von Chlorwasserstoff und Wasserstoff und Chlor, die nach einem Kettenmechanismus (H 2 + Cl 2 = 2HCl) abläuft, die Bildung einer Kette dem Prozess
Cl2  2 ∙
Cl
2 ∙
Cl
Die Kettenentwicklung ist eine periodische Wiederholung von Reaktionsschritten, an denen die resultierenden Radikale beteiligt sind. Sie werden auch Kettenglieder genannt:
H 2 + · Cl→HCl+ ˙ H
˙ H+Cl 2 →HCl+ ˙ Cl
H2+ ˙ Cl→HCl+ ˙ H
Cl2+ ˙ H→HCl+ ˙ Cli usw.
Die Länge der Kette wird durch die Anzahl der Moleküle der Ausgangssubstanz bestimmt, die infolge eines Kettenkeimbildungsvorgangs reagiert haben, bevor sie zerbricht.
Entsprechend den Merkmalen des Entwicklungsstadiums werden Kettenreaktionen unterteilt in unverzweigt Und verzweigt. Im ersten Fall bleibt die Anzahl der freien aktiven Radikalpartikel während der gesamten Phase unverändert.
In verzweigten Kettenreaktionen Der Verbrauch eines aktiven Partikels führt zur Bildung mehrerer (zwei oder mehr) anderer aktiver Partikel. Schematisch lässt sich dies wie folgt darstellen:

Der Kettenabbruch entspricht dem Verschwinden aktiver Teilchen aufgrund ihrer Wechselwirkung miteinander:
˙ H+ ˙ H=H2
˙ Cl+ ˙ Cl=Cl 2 offener Kreislauf
˙ H+ ˙ Cl=HCl
Darüber hinaus kann es bei der Adsorption von Partikeln an den Wänden eines Gefäßes auftreten, wenn zwei aktive Partikel mit einem dritten (einem sogenannten Inhibitor) kollidieren, an den die aktiven Partikel überschüssige Energie abgeben. Daher sind Kettenreaktionen dadurch gekennzeichnet, dass ihre Geschwindigkeit von der Größe, Form und dem Material des Reaktionsgefäßes sowie vom Vorhandensein fremder inerter Substanzen abhängt, die als Inhibitor wirken.
Die Geschwindigkeit unverzweigter Kettenreaktionen wird durch die Geschwindigkeit der langsamsten Stufe bestimmt, d.h. der Ursprung der Kette. Für jede Stufe bei Reaktionen dieser Art werden die üblichen Gleichungen der chemischen Kinetik (erster oder zweiter Ordnung) verwendet.
Verzweigte chemische Reaktionen können nach einem komplexen kinetischen Gesetz ablaufen und haben keine bestimmte Reihenfolge. Die „Vermehrung“ von Radikalen in ihnen führt oft zu einem lawinenartigen Prozess, der eine Explosion auslöst. Allerdings ist bei diesen Reaktionen auch ein Kettenabbruch möglich. Daher kommt es zu einem schnellen Anstieg der Geschwindigkeit des Prozesses (bis hin zur Explosion), wenn die Verzweigungsgeschwindigkeit der Kette die Geschwindigkeit ihres Bruchs übersteigt. Die Theorie der Kettenreaktionen wurde in den Werken des Akademiemitglieds N.N. entwickelt. Semyonova, S.N. Hinshelwood (England) und andere Wissenschaftler.
Es gibt Kettenreaktionen, bei denen die aktiven Teilchen keine Radikale sind, sondern Ionen, die durch heterolytische Spaltung einer chemischen Bindung entstehen:
A : B → A ˉ : +B+
Ein ähnlicher Mechanismus wird in der Praxis häufig bei Polymerisationsreaktionen ungesättigter organischer Verbindungen realisiert.
Alle Stoffe werden in einfache und komplexe Stoffe unterteilt.
Einfache Substanzen- Das sind Stoffe, die aus Atomen eines Elements bestehen.
In einigen einfachen Substanzen verbinden sich Atome desselben Elements zu Molekülen. Solche einfachen Substanzen haben molekulare Struktur. Diese beinhalten: , . Alle diese Stoffe bestehen aus zweiatomigen Molekülen. (Beachten Sie, dass die Namen der einfachen Stoffe mit den Namen der Elemente identisch sind!)
Andere einfache Substanzen haben atomare Struktur, d. h. sie bestehen aus Atomen, zwischen denen bestimmte Bindungen bestehen. Beispiele für solche einfachen Substanzen sind alle (usw.) und einige (usw.). Nicht nur die Namen, sondern auch die Formeln dieser einfachen Stoffe stimmen mit den Symbolen der Elemente überein.
Es gibt auch eine Gruppe einfacher Substanzen namens. Dazu gehören: Helium He, Neon Ne, Argon Ar, Krypton Kr, Xenon Xe, Radon Rn. Diese einfachen Substanzen bestehen aus Atomen, die nicht miteinander verbunden sind.
Jedes Element bildet mindestens eine einfache Substanz. Einige Elemente können nicht eine, sondern zwei oder mehr einfache Substanzen bilden. Dieses Phänomen wird Allotropie genannt.
Allotropie ist das Phänomen der Bildung mehrerer einfacher Stoffe durch ein Element.
Verschiedene einfache Stoffe, die aus demselben chemischen Element entstehen, werden allotrope Modifikationen genannt.
Allotrope Modifikationen können sich in der molekularen Zusammensetzung voneinander unterscheiden. Beispielsweise bildet das Element Sauerstoff zwei einfache Stoffe. Eines davon besteht aus zweiatomigen Molekülen O 2 und trägt den gleichen Namen wie das Element-. Eine weitere einfache Substanz besteht aus dreiatomigen Molekülen O 3 und hat einen eigenen Namen – Ozon.
Sauerstoff O 2 und Ozon O 3 haben unterschiedliche physikalische und chemische Eigenschaften.
Allotrope Modifikationen können Feststoffe sein, die unterschiedliche Kristallstrukturen aufweisen. Ein Beispiel sind die allotropen Modifikationen von Kohlenstoff C – Diamant und Graphit.
Die Zahl der bekannten einfachen Stoffe (ca. 400) ist deutlich größer als die Zahl der chemischen Elemente, da viele Elemente zwei oder mehr allotrope Modifikationen bilden können.
Komplexe Substanzen- Das sind Stoffe, die aus Atomen verschiedener Elemente bestehen.
Beispiele für komplexe Stoffe: HCl, H 2 O, NaCl, CO 2, H 2 SO 4 usw.
Komplexe Stoffe werden oft als chemische Verbindungen bezeichnet. Bei chemischen Verbindungen bleiben die Eigenschaften der einfachen Stoffe, aus denen diese Verbindungen entstehen, nicht erhalten. Die Eigenschaften eines komplexen Stoffes unterscheiden sich von den Eigenschaften der einfachen Stoffe, aus denen er besteht.
Beispielsweise kann Natriumchlorid NaCl aus einfachen Substanzen gebildet werden – metallischem Natrium Na und gasförmigem Chlor Cl. Die physikalischen und chemischen Eigenschaften von NaCl unterscheiden sich von den Eigenschaften von Na und Cl 2.
In der Natur kommen in der Regel keine Reinstoffe, sondern Stoffgemische vor. Auch in der Praxis verwenden wir meist Stoffgemische. Jedes Gemisch besteht aus zwei oder mehreren Stoffen namens Mischungskomponenten.
Luft ist beispielsweise ein Gemisch aus mehreren gasförmigen Stoffen: Sauerstoff O 2 (21 Vol.-%), (78 %) usw. Gemische sind Lösungen vieler Stoffe, Legierungen einiger Metalle usw.
Stoffgemische sind homogen (homogen) und heterogen (heterogen).
Homogene Mischungen- Dabei handelt es sich um Gemische, bei denen es keine Grenzfläche zwischen den Komponenten gibt.
Gemische aus Gasen (insbesondere Luft) und flüssigen Lösungen (z. B. eine Lösung von Zucker in Wasser) sind homogen.
Heterogene Mischungen- Hierbei handelt es sich um Gemische, bei denen die Komponenten durch eine Grenzfläche getrennt sind.
Heterogen sind Mischungen aus Feststoffen (Sand + Kreidepulver), Mischungen aus ineinander unlöslichen Flüssigkeiten (Wasser + Öl), Mischungen aus Flüssigkeiten und darin unlöslichen Feststoffen (Wasser + Kreide).
Die wichtigsten Unterschiede zwischen Gemischen und chemischen Verbindungen:
- In Mischungen bleiben die Eigenschaften einzelner Stoffe (Komponenten) erhalten.
- Die Zusammensetzung von Gemischen ist nicht konstant.
Ein internationales Wissenschaftlerteam synthetisierte und untersuchte Seaborgiumhexacarbonyl, Sg(CO)6, eine Verbindung des instabilen Elements mit der Ordnungszahl 106 mit Kohlenmonoxid, und verglich es auch mit ähnlichen Verbindungen der instabilen Isotope Molybdän und Wolfram, Homologe von Seaborgium . Dies ist die komplexeste experimentell erhaltene chemische Verbindung, zu der ein Transactinoid gehört, also ein Element mit einer Ordnungszahl über 103. In den chemischen Eigenschaften von Transactinoiden sind die Auswirkungen der Relativitätstheorie für innere Elektronen am stärksten ausgeprägt, daher die Das Studium der Chemie von Transactinoiden ermöglicht die Klärung der gesamten Theorie zur Berechnung der elektronischen Struktur schwerer Atome.
Das Periodensystem der chemischen Elemente ist bereits bis zur Nummer 118 gefüllt (Abb. 1). Seine gesamte Struktur spiegelt die Periodizität der chemischen Eigenschaften von Elementen mit zunehmender Ordnungszahl wider, die mit der allmählichen Füllung elektronischer Hüllen entsteht. Wenn sich zwei chemische Elemente in der Anzahl vollständig gefüllter innerer Elektronenhüllen unterscheiden, aber über ähnliche Außenelektronen verfügen, die für die chemische Bindung verantwortlich sind, sollten die beiden Elemente ähnliche chemische Eigenschaften haben. Diese Reihen von Elementen werden Homologe voneinander genannt und befinden sich im Periodensystem in derselben Gruppe übereinander. Beispielsweise sind die Übergangsmetalle der sechsten Gruppe – Chrom, Molybdän, Wolfram und das superschwere Element Nummer 106 Seaborgium – homolog zueinander. Während die chemischen Eigenschaften der ersten drei von ihnen schon seit langem bekannt sind, wird die Chemie von Seaborgium gerade erst erforscht. Basierend auf dem Periodensystem kann jedoch davon ausgegangen werden, dass ihre chemischen Eigenschaften ähnlich sind.
Beim Vergleich der chemischen Eigenschaften homologer Elemente gibt es eine wichtige Gefahr. In schweren Atomen bewegen sich die inneren Elektronen mit nahezu Lichtgeschwindigkeit, wodurch die Auswirkungen der Relativitätstheorie voll zum Tragen kommen. Sie führen zu einer zusätzlichen Kompression der s- und p-Orbitale und in der Folge zu einer gewissen Ausdehnung der äußeren Elektronenwolken. Eine große Kernladung verstärkt auch die Auswirkungen der Wechselwirkung der Elektronen untereinander, beispielsweise die Spin-Bahn-Aufspaltung. All dies beeinflusst die chemische Bindung eines Schweratoms mit bestimmten Nachbarn. Und die moderne theoretische Chemie sollte in der Lage sein, alle diese Effekte richtig zu berechnen.
Je schwerer das Atom, desto stärker sind die relativistischen Effekte. Es scheint naheliegend, die schwersten bekannten Elemente, die Transactinoide, Elemente mit einer Ordnungszahl über 103, zu verwenden, um theoretische Berechnungen zu testen (Abbildung 1). Auf dem Weg zu ihrer experimentellen Untersuchung treten jedoch einige erhebliche Schwierigkeiten auf.
Erstens sind die Atomkerne transaktinoider Elemente sehr instabil; Ihre typische Lebensdauer beträgt Minuten, Sekunden oder sogar Bruchteile einer Sekunde. Von einer Anhäufung einer makroskopischen Materiemenge kann daher keine Rede sein, wir müssen mit einzelnen Atomen unmittelbar nach ihrer Geburt arbeiten.
Ohne die zweite Schwierigkeit wäre das kein großes Problem: Diese Atome sind nur in erhältlich Stückmengen. Superschwere Atome werden in Kernreaktionen synthetisiert, bei denen zwei andere ziemlich schwere Atome mit einem hohen Neutronengehalt verschmelzen. Dazu wird ein Strahl schwerer Ionen einer Art auf ein Ziel gerichtet, das schwere Atome einer anderen Art enthält, und bei der Kollision kommt es zu Kernreaktionen. In den allermeisten Fällen erzeugen sie nur kleinere Fragmente, und nur gelegentlich kommt es vor, dass der gewünschte superschwere Kern aus der Verschmelzung zweier Kerne entsteht. Infolgedessen erweist sich die Produktionsrate superschwerer Kerne bei kontinuierlicher Bestrahlung eines Ziels als lächerlich niedrig: in der Größenordnung von einem pro Minute, pro Stunde, pro Tag oder sogar pro Woche.
Diese Geburtstechnologie führt zu einem dritten Problem. Die Synthese superschwerer Atome erfolgt unter Bedingungen ständiger starker Strahlung eines auf das Ziel treffenden Strahls und infolgedessen in Gegenwart eines riesigen Stroms fremder Kerntrümmer. Selbst wenn der gewünschte Kern geboren wird, Elektronen aus der Umgebung aufnimmt, zu einem echten Atom wird und schließlich unmittelbar hinter dem Ziel eine chemische Reaktion eingeht, um eine neue Verbindung zu bilden, steht diese Verbindung unter harten Strahlungsbedingungen und in ständigem Kontakt mit Plasma, das durch harte Ionisation entsteht Die Tatsache, dass es unter diesen Bedingungen generell möglich ist, irgendeine Art von Chemie von Transactinoiden bis hin zu Flerovium (Element 114) zu studieren, ist an sich schon eine große Leistung. Bisher waren jedoch alle chemischen Verbindungen, an denen Transactinoide beteiligt sind, aus chemischer Sicht sehr einfach – Halogenide, Oxide und andere ähnliche Verbindungen mit einem Schweratom in der maximalen Oxidationsstufe. Zerbrechlichere chemische Verbindungen mit nicht trivialen chemischen Bindungen werden durch starke Strahlung schnell zerstört. Und all dies macht es leider schwierig, die chemischen Eigenschaften von Transactinoiden zu testen.
Neulich in einer Zeitschrift Wissenschaft wurde veröffentlicht und markierte den Beginn der „nicht-trivialen“ Transactinoid-Chemie. Es berichtet über die Synthese und experimentelle Untersuchung der Verbindung Sg(CO) 6, Seaborgiumhexacarbonyl (Abb. 2). Darüber hinaus wurden im gleichen Aufbau und mit den gleichen Methoden auch Hexacarbonylkomplexe der homologen Elemente Seaborgium, Mo(CO) 6 und W(CO) 6 sowie kurzlebige Isotope von Molybdän und Wolfram mit einer Halbwertszeit von untersucht mehrere Sekunden oder Minuten.
Das Haupthighlight dieser Arbeit ist ein kombinierter Versuchsaufbau, der mehrere technische Fortschritte des letzten Jahrzehnts vereint. Diese Installation überwindet das dritte der oben genannten Probleme – sie trennt den Bereich der Synthese superschwerer Kerne und den Bereich der physikalisch-chemischen Erforschung der resultierenden Verbindung räumlich. Sein allgemeines Erscheinungsbild ist in Abb. dargestellt. 3. Am Eingang der Anlage (von rechts nach links im Hintergrund der Abbildung) interagiert ein Kernstrahl mit dem Ziel und erzeugt einen „Cocktail“ aus Sekundärkernen. Die Reaktionsprodukte werden durch ein Dipolmagnetfeld (Element D in der Abbildung) abgelenkt, und zwar auf unterschiedliche Weise für unterschiedliche Ladungs- und Massenverhältnisse der Kerne. Die Größe des Magnetfeldes wird so berechnet, dass nur die untersuchten Kerne das System der magnetischen Linsen (Q) passieren, während die Hintergrundkerne und der ursprüngliche Strahl abgelenkt werden. Im Wesentlichen reproduziert diese Technik die bekannte Massenspektrometrie, die auf Kerne angewendet wird.
Im nächsten Schritt gelangen die abgetrennten Kerne (Sg, Mo oder W) in die RTC-Kammer, durch die ein Gasgemisch aus Helium und Kohlenmonoxid geblasen wird. Ein wichtiger Punkt: Auf dem Weg in die Kammer passieren die Kerne ein Fenster mit genau definierter Dicke aus Mylar. Es dämpft die kinetische Energie heißer Kerne und ermöglicht deren Thermalisierung (Verlangsamung auf die Energie der thermischen Bewegung von Molekülen) innerhalb der Gaskammer. Dort werden die Kerne „mit Elektronen bekleidet“ und bilden durch eine chemische Reaktion mit Kohlenmonoxid eine Verbindung – einen Carbonylkomplex. Da die Verbindung flüchtig ist, wird sie mit dem gesamten Gasstrom durch eine 10 Meter lange Teflonkapillare zum zweiten Teil der Anlage – einem speziellen COMPACT-Analysator – transportiert.
Der Name COMPACT steht für Cryo-Online-Multidetektor für Physik und Chemie von Transactinoiden. Bei dieser Installation handelt es sich um eine ganze Reihe von 32 Halbleiterdetektorpaaren für die Gasthermochromatographie von Verbindungen instabiler Elemente. Entlang der Linie entsteht ein starker Temperaturgradient: Jedes Detektorpaar hat seine eigene Temperatur, von +30 °C am Anfang der Linie bis –120 °C am Ende. Jeder Detektor ist in der Lage, α- und β-Partikel, die von Kernen während ihres Zerfalls emittiert werden, aufzuzeichnen und ihre Energie und Abflugzeit mit hoher Genauigkeit zu messen. Dies ist notwendig, um Seaborgium-Kerne anhand ihrer charakteristischen Zerfallskette zu identifizieren, bei der nacheinander Alphateilchen bestimmter Energien emittiert werden, und um diese seltenen Ereignisse nicht mit Hintergrundprozessen zu verwechseln.
So funktioniert der COMPACT-Analysator. Wenn das Gasgemisch durch das Lineal geblasen wird, lagern sich Moleküle des Carbonylkomplexes des Schwermetalls auf der Oberfläche eines bestimmten Detektors ab, wo sie nach dem radioaktiven Zerfall aufgezeichnet werden. Die Nummer des Detektors, in dem der Zerfall aufgezeichnet wird, gibt an, bei welcher Temperatur die Absorption des Moleküls energetisch günstig wird. Diese Temperatur wird durch die physikalisch-chemischen Eigenschaften des untersuchten Carbonylkomplexes bestimmt – die Adsorptionsenthalpie. Nun, genau diese Eigenschaft der Materie wird wiederum durch chemische Berechnungen vorhergesagt, bei denen relativistische Effekte eine erhebliche Rolle spielen. Durch die Messung der Ablagerung von Sg(CO) 6 , W(CO) 6 und Mo(CO) 6 im COMPACT-Analysator können chemische theoretische Berechnungen verifiziert und die Adsorptionsenthalpie dieser Spezies gemessen werden.

Die Ergebnisse dieser Studie sind in Abb. dargestellt. 4. Hier sind mehrere Merkmale in jedem der 32 Detektorpaare aufgeführt. Das obere Diagramm ist einfach die Temperaturverteilung entlang eines Lineals. Die mittleren und unteren Diagramme zeigen tatsächlich die experimentellen Daten selbst – die Verteilung der aufgezeichneten Zerfälle der Kerne Wolfram-164 (in der Mitte) und Seaborgium-265 (unten) über die Detektoren. Natürlich gibt es hier nicht genügend Ereignisse mit Seaborgium – während zwei Wochen kontinuierlicher Bestrahlung des Ziels mit einem intensiven Strahl wurden insgesamt 18 davon aufgezeichnet. Dennoch ist deutlich zu erkennen, dass sie bei Detektoren mit Zahlen über 20 nicht gleichmäßig entlang der Linie, sondern näher an deren Ende verteilt sind. Etwa das gleiche Bild ergab sich bei der Modellierung dieses Prozesses mit der erst kürzlich berechneten Adsorptionsenthalpie eine theoretische Arbeit nur für diese Stoffe. Ein ähnliches Bild ergibt sich für Verbindungen mit einem instabilen Wolframisotop und mit Molybdänisotopen (sie sind in der Abbildung nicht dargestellt): Das Maximum der Verteilungen liegt genau dort, wo theoretische Berechnungen es vorhersagen. Dieser Zufall gibt zusätzliches Vertrauen, dass moderne Methoden der vollständig relativistischen Berechnung der Struktur schwerer Atome experimentelle Daten angemessen beschreiben.
Abschließend ist es sinnvoll, diese Forschung aus der Vogelperspektive zu betrachten. Typischerweise sind instabile superschwere Elemente für Physiker von Interesse, um neue Erkenntnisse in der Kernphysik zu gewinnen. Da es die Natur jedoch zulässt, können diese Elemente für einen anderen Zweck verwendet werden – um zu testen, wie gut wir vorhersagen können chemisch Eigenschaften solcher Atome. Dieses Wissen wiederum benötigen wir nicht an sich, sondern als zusätzlichen Test der gesamten modernen Theorie zur Berechnung der elektronischen Strukturen schwerer Atome unter Berücksichtigung relativistischer Effekte. Und von hier aus folgen zahlreiche Anwendungen, von der rein angewandten Forschung bis hin zur echten Grundlagenwissenschaft. Die Chemie der Transactinoide verdeutlicht einmal mehr, wie stark die unterschiedlichsten Bereiche der Physik und benachbarter Disziplinen miteinander verbunden sind.