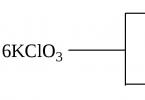A körülöttünk lévő világban előforduló és az iparban használt kémiai reakciók többsége összetett. A mechanizmustól függően ezek fel vannak osztva megfordítható,párhuzamos,egymás utáni,konjugált,lánc.
A reverzibilis reakciók közé tartoznak azok a reakciók, amelyek adott körülmények között spontán módon mind előre, mind hátrafelé fordulhatnak elő. Általában a reverzibilis reakció kémiai egyenlete a következő:
aA + bB+ … ↔cC+dD+ …,
hol egy,b, Val vel,d,…. – sztöchiometrikus együtthatók a kezdő (A, B, ....) és a végképletek (C,D, ...) anyagok.
Példa az élő szervezetekben előforduló reverzibilis folyamatra az észterezési reakció:
R 1 – COOH + HO – R 2 ↔ R 1 – C(O)O – R 2 + H 2 O,
és az iparban használatos - ammónia szintézise nitrogénből és hidrogénből:
3 H 2 +N 2 ↔ 2NH 3
Ca reverzibilis reakció sebessége megegyezik az előre és a fordított reakció sebessége közötti különbséggel.
A párhuzamos reakciók a következő formájú reakciók:
azaz, amelyben ugyanazok a kiindulási anyagok egymással egyidejűleg reagálva különböző termékeket képeznek.
Az ilyen típusú reakcióra példa a Berthollet-só KClO 3 bomlási reakciója, amely bizonyos körülmények között két irányban mehet végbe.

Ezzel párhuzamosan egyes radioaktív elemek atommagjainak bomlása két vagy több mechanizmus révén is megtörténhet. Párhuzamos reakciók különösen gyakran fordulnak elő a szerves kémiában. Például, ha a toluolt kénsavval szulfonálják, egyidejűleg orto- és paraszulfoszármazékok képződhetnek:

Egyes esetekben az élő szervezetek sejtjeiben végbemenő biokémiai reakciók párhuzamosak is lehetnek. Például a glükóz enzimatikus fermentációja:
1) C6H12O6  2 C 2 H 5 OH+ 2CO 2
2 C 2 H 5 OH+ 2CO 2
alkoholos erjesztés
2) C6H12O6  СH 3 – CH(OH) – COOH
СH 3 – CH(OH) – COOH
tejsavas fermentáció
Bizonyos körülmények között sok párhuzamos reakció túlnyomórészt csak egy irányba mehet végbe.
A párhuzamos reakció sebességét a leggyorsabb szakaszának sebessége határozza meg.
A szekvenciális reakciók azok, amelyekben a végtermék képződése a kiindulási anyagokból nem közvetlenül, hanem szükségszerűen egy sor közbenső szakaszon keresztül megy végbe, egymás után, szigorúan meghatározott sorrendben. Sematikusan ez a folyamat a következőképpen ábrázolható:
A → B → C → D,
ahol minden betű a folyamat egy külön szakaszát jelöli. Általában az ilyen szakaszok száma az egymást követő reakciókban nagyon eltérő lehet (több egységtől több tízig). Ráadásul az egyes szakaszok nem feltétlenül egyszerű mono- vagy bimolekuláris reakciók, hanem összetettek is lehetnek.
A szekvenciális reakciók gyakoriak a természetben, és különösen gyakran figyelhetők meg az élő szervezetekben és növényekben előforduló biokémiai folyamatokban. Ilyen reakciók például a fotoszintézis és a glükóz biológiai oxidációja, az oligo- és poliszacharidok hidrolízise stb.
A szekvenciális reakciók kinetikájának kiszámítása bonyolult, és csak viszonylag egyszerű, kis számú szakaszból álló folyamatok esetén végezhető elég pontosan.
Ha azonban egy szekvenciális reakció egyik szakasza lényegesen kisebb sebességgel rendelkezik, mint az összes többi, akkor a teljes reakciósebességet ennek a szakasznak a sebessége határozza meg, amelyet ebben az esetben ún.korlátozó.
Például a nitrogén-monoxid (II) klórozási reakciója
2NO+Cl2 = 2NOCl
két szakaszból áll:
1) NO + Cl 2 = NOCl 2;
2) NOCl 2 + NO = 2NOCl
Az első szakasz gyorsan lezajlik az instabil NOCl 2 termék képződésével. A második szakasz lassú és korlátozó. A teljes reakció sebességét a kinetikai egyenlet írja le
= k  ·C NO
·C NO
és ennek a reakciónak a sorrendje 2.
A következő séma szerint lezajló reakciókat konjugátumnak nevezzük:
Ezen reakciók egyike önállóan is lezajlik, és a második reakció csak az első jelenlétében kivitelezhető. Így az egyik reakció bekövetkezése elindítja a második megvalósítását.
Konjugált reakciók lehetségesek a biokémiában. A sejtekben fordulnak elő, és a második reakcióhoz szükséges energiát ΔG 2 > 0 esetén az első reakció biztosítja, amelyhez ΔG 1< 0. Причём │ΔG 1 │>│ΔG 2 │, azaz az egész folyamat összességében a Gibbs-energia csökkenésével megy végbe. Az ilyen biokémiai reakciókat más néven tandem.
A konjugált reakciók mechanizmusa gyakran abban áll, hogy az első szakaszban aktív köztes részecskék (gyökök vagy ionok) képződnek, amelyek elindítják az összes többi reakció bekövetkezését.
Az ilyen típusú konjugált reakciók sémája általában a következőképpen ábrázolható:

ahol C az aktív köztes részecske.
Például a vizes oldatban lévő benzolt nem oxidálja a H 2 O 2, hanem ha kétértékű vassót adunk hozzá, fenollá és bifenillé alakul. A folyamat elindításához a Fe 2+ -ionok először kölcsönhatásba lépnek a H 2 O 2 -vel, és OH gyököket képeznek.
Fe 2+ + H 2 O 2 → Fe 3+ + OH – + ˙ Ó,
amelyek ezután a benzolhoz hasonlóan reagálnak
C6H6+ ˙ Ó → ˙ C 6 H 5 + H 2 O
˙ C6H5+ ˙ OH → C6H5OH
ugyanez a Fe 2+-mal
Fe 2++ ˙ OH→Fe 3+ +OH –
A kémiai indukció jelenségét először N.A. Shilov 1905-ben
A láncreakciók olyan kémiai reakciók, amelyek rendszeresen ismétlődő elemi szakaszokon mennek keresztül, aktív részecskék részvételével, amelyek külső energiaszinten párosítatlan elektronokkal rendelkező atomokat (vagy más szóval szabad gyököket) tartalmaznak.
A láncreakciók közé tartozik az égés, a polimerizáció és a polikondenzáció, a nukleáris bomlás stb.
A láncreakciók mechanizmusa az, hogy a szabad gyökök (gyakran egyes atomok) nagy kémiai aktivitással rendelkeznek. Könnyen kölcsönhatásba lépnek a stabil molekulákkal és aktív részecskéket alakítanak át, amelyekből reakciótermékek és új gyökök keletkeznek, és így további szakaszok láncolata jön létre. A láncreakció addig tart, amíg a teljes anyag reakcióba lép, vagy amíg az aktív gyökrészecskék el nem tűnnek.
A láncreakciókat három szakasz jellemzi: 1) lánckezdés; 2)láncfejlődés vagy növekedés; 3)nyitott áramkör.
A lánc beindítása egy elemi kémiai aktussal kezdődik, melynek eredményeként aktív részecske képződik. Ez a folyamat energiát igényel, és előfordulhat az anyag melegítésével, ionizáló sugárzással vagy katalizátorral.
Például a hidrogén-klorid és a hidrogén és a klór szintézisének reakciójában, amely láncmechanizmus szerint megy végbe (H 2 + Cl 2 = 2HCl), a lánc képződése megfelel a folyamatnak.
Cl2  2 ∙
Cl
2 ∙
Cl
A láncfejlődés a reakciólépések időszakos ismétlődése, amelyben a keletkező gyökök is részt vesznek. Más néven láncszemek:
H2+ · Cl→HCl+ ˙ H
˙ H+Cl2 →HCl+ ˙ Cl
H2+ ˙ Cl→HCl+ ˙ H
Cl2+ ˙ H^HCl+ ˙ Cli stb.
A lánc hosszát a kiindulási anyag azon molekuláinak száma határozza meg, amelyek egy láncmagképződés eredményeként reagáltak, mielőtt az elszakadna.
A fejlődési szakasz jellemzői szerint a láncreakciókat felosztják el nem ágazóÉs elágazó. Az első esetben a szabad gyökrészecskék száma változatlan marad a teljes szakaszban.
Elágazó láncreakciókban egy aktív részecske elfogyasztása több (két vagy több) további aktív részecske képződéséhez vezet. Sematikusan ez a következőképpen ábrázolható:

A lánclezárás az aktív részecskék eltűnésének felel meg az egymással való kölcsönhatás következtében:
˙ H+ ˙ H=H2
˙ Cl+ ˙ Cl=Cl 2 szakadt áramkör
˙ H+ ˙ Cl=HCl
Ezenkívül előfordulhat a részecskék edény falán történő adszorpciója során, amikor két aktív részecske ütközik egy harmadikkal (úgynevezett inhibitor), amelyre az aktív részecskék felesleges energiát adnak le. Ezért a láncreakciókat az jellemzi, hogy sebességük függ a reakcióedény méretétől, alakjától és anyagától, valamint az inhibitorként ható idegen inert anyagok jelenlététől.
Az el nem ágazó láncreakciók sebességét a leglassabb szakasz sebessége határozza meg, pl. a lánc eredete. Az ilyen típusú reakciók minden szakaszában a szokásos (első vagy másodrendű) kémiai kinetikai egyenleteket alkalmazzuk.
Az elágazó kémiai reakciók bonyolult kinetikai törvény szerint mehet végbe, és nincs meghatározott sorrendjük. A bennük lévő gyökök „reprodukciója” gyakran lavinaszerű folyamathoz vezet, ami robbanást okoz. Azonban ezekben a reakciókban a lánc lezárása is lehetséges. Ezért a folyamat sebességének gyors növekedése (akár robbanásig) következik be, ha a lánc elágazási sebessége meghaladja a szakadás sebességét. A láncreakciók elméletét akadémikus N.N. Szemjonova, S.N. Hinshelwood (Anglia) és más tudósok.
Vannak olyan láncreakciók, amelyekben az aktív részecskék nem gyökök, hanem ionok, amelyek egy kémiai kötés heterolitikus hasítása eredményeként képződnek:
A : B → A ˉ : +B+
Hasonló mechanizmus a gyakorlatban gyakran valósul meg telítetlen szerves vegyületek polimerizációs reakcióiban.
Minden anyag egyszerű és összetett.
Egyszerű anyagok- Ezek olyan anyagok, amelyek egy elem atomjaiból állnak.
Egyes egyszerű anyagokban ugyanannak az elemnek az atomjai egyesülnek egymással és molekulákat alkotnak. Az ilyen egyszerű anyagok rendelkeznek molekuláris szerkezet. Ezek tartalmazzák: , . Mindezek az anyagok kétatomos molekulákból állnak. (Megjegyzendő, hogy az egyszerű anyagok neve megegyezik az elemek nevével!)
Más egyszerű anyagok rendelkeznek atomszerkezet, azaz atomokból állnak, amelyek között bizonyos kötések vannak. Ilyen egyszerű anyagokra példa az összes ( stb.) és néhány ( stb.). Ezeknek az egyszerű anyagoknak nemcsak a neve, hanem a képlete is egybeesik az elemek szimbólumaival.
Létezik az egyszerű anyagok egy csoportja is, az úgynevezett. Ide tartoznak: hélium He, neon Ne, argon Ar, kripton Kr, xenon Xe, radon Rn. Ezek az egyszerű anyagok olyan atomokból állnak, amelyek nem kapcsolódnak egymáshoz.
Minden elem legalább egy egyszerű anyagot alkot. Egyes elemek nem egy, hanem két vagy több egyszerű anyagot alkothatnak. Ezt a jelenséget allotrópiának nevezik.
Allotrópia az a jelenség, amikor egy elem több egyszerű anyag képződik.
Az ugyanazon kémiai elem által képződő különböző egyszerű anyagokat allotróp módosulásoknak nevezzük.
Az allotróp módosulások molekulaösszetételükben eltérhetnek egymástól. Például az oxigén elem két egyszerű anyagot képez. Az egyik kétatomos O 2 molekulákból áll, és ugyanaz a neve, mint az elem-. Egy másik egyszerű anyag O 3 háromatomos molekulákból áll, és saját neve van - ózon.
Az oxigén O 2 és az ózon O 3 különböző fizikai és kémiai tulajdonságokkal rendelkezik.
Az allotróp módosulatok lehetnek szilárd anyagok, amelyek különböző kristályszerkezettel rendelkeznek. Példa erre a szén C - gyémánt és grafit allotróp módosulatai.
Az ismert egyszerű anyagok száma (körülbelül 400) lényegesen nagyobb, mint a kémiai elemek száma, mivel sok elem kettő vagy több allotróp módosulatot alkothat.
Komplex anyagok- Ezek olyan anyagok, amelyek különböző elemek atomjaiból állnak.
Példák összetett anyagokra: HCl, H 2 O, NaCl, CO 2, H 2 SO 4 stb.
Az összetett anyagokat gyakran kémiai vegyületeknek nevezik. A kémiai vegyületekben nem őrzik meg azon egyszerű anyagok tulajdonságait, amelyekből ezek a vegyületek keletkeznek. Egy összetett anyag tulajdonságai eltérnek azon egyszerű anyagok tulajdonságaitól, amelyekből keletkezik.
Például nátrium-klorid NaCl képződhet egyszerű anyagokból - fémes nátrium Na és gáznemű klór Cl. A NaCl fizikai és kémiai tulajdonságai eltérnek a Na és Cl 2 tulajdonságaitól.
A természetben általában nem tiszta anyagok vannak, hanem anyagok keverékei. A gyakorlati tevékenységek során általában anyagkeverékeket is alkalmazunk. Bármely keverék két vagy több ún keverék komponensei.
Például a levegő több gáznemű anyag keveréke: oxigén O 2 (21 térfogatszázalék), (78%) stb. A keverékek számos anyag oldatai, egyes fémek ötvözetei stb.
Az anyagok keverékei homogének (homogén) és heterogének (heterogének).
Homogén keverékek- ezek olyan keverékek, amelyekben az összetevők között nincs határfelület.
A gázok (különösen a levegő) és a folyékony oldatok (például a cukor vizes oldata) keverékei homogének.
Heterogén keverékek- Ezek olyan keverékek, amelyekben a komponenseket interfész választja el.
A heterogének közé tartoznak a szilárd anyagok keverékei (homok + krétapor), az egymásban oldhatatlan folyadékok keverékei (víz + olaj), a folyadékok és az abban oldhatatlan szilárd anyagok keverékei (víz + kréta).
A keverékek és a kémiai vegyületek közötti legfontosabb különbségek:
- A keverékekben az egyes anyagok (komponensek) tulajdonságai megmaradnak.
- A keverékek összetétele nem állandó.
Egy nemzetközi tudóscsoport szintetizálta és tanulmányozta a seaborgium-hexakarbonilt, az Sg(CO)6-ot, a 106-os instabil elem szén-monoxiddal alkotott vegyületét, és összehasonlította a molibdén és volfrám instabil izotópjainak hasonló vegyületeivel, amelyek a seaborgium homológjai. . Ez a legösszetettebb kísérleti úton előállított kémiai vegyület, amely egy transzaktinoidot, azaz egy 103 feletti rendszámú elemet tartalmaz. A transzaktinoidok kémiai tulajdonságaiban a relativitáselmélet belső elektronokra gyakorolt hatása a legkifejezettebb, ezért a A transzaktinoidok kémiájának tanulmányozása lehetővé teszi a nehéz atomok elektronszerkezetének kiszámításának teljes elméletének tisztázását.
A kémiai elemek periódusos táblázata már a 118-as számig meg van töltve (1. ábra). Teljes szerkezete tükrözi a növekvő rendszámú elemek kémiai tulajdonságainak periodicitását, amely az elektronikus héjak fokozatos feltöltődésével jön létre. Ha két kémiai elem eltér a teljesen kitöltött belső elektronhéjak számában, de hasonló külső elektronokkal rendelkeznek - amelyek a kémiai kötésért felelősek -, akkor a két elemnek hasonló kémiai tulajdonságokkal kell rendelkeznie. Ezeket az elemek sorozatait egymás homológjainak nevezzük, és a periódusos rendszerben ugyanabban a csoportban helyezkednek el, egymás fölött. Például a hatodik csoportot alkotó átmeneti fémek - króm, molibdén, volfrám és a 106-os számú szupernehéz elem seaborgium - egymás homológjai. Míg közülük az első három kémiai tulajdonságai már régóta ismertek, a seaborgium kémiáját még csak most kezdik tanulmányozni. A periódusos rendszer alapján azonban kémiai tulajdonságaik várhatóan hasonlóak lesznek.
A homológ elemek kémiai tulajdonságainak összehasonlításakor van egy fontos buktató. A nehéz atomokban a belső elektronok közel fénysebességgel mozognak, és emiatt a relativitáselmélet hatásai maximálisan érvényesülnek. Ezek az s- és p-pályák további összenyomódásához vezetnek, és ennek következtében a külső elektronfelhők némi tágulásához. A nagy magtöltés az elektronok egymással kölcsönhatásba lépő hatásait is fokozza, például a spin-pályahasadást. Mindez hatással van egy nehéz atom kémiai kötésére bizonyos szomszédokkal. A modern elméleti kémiának pedig képesnek kell lennie mindezen hatások helyes kiszámítására.
Minél nehezebb az atom, annál erősebbek a relativisztikus hatások. Természetesnek tűnik, hogy a legnehezebb ismert elemeket, a 103-nál nagyobb rendszámú transzaktinoidokat használjuk az elméleti számítások tesztelésére (1. ábra). Kísérleti tanulmányaik felé azonban számos jelentős nehézség adódik.
Először is, a transzaktinoid elemek atommagjai nagyon instabilok; tipikus élettartamuk percek, másodpercek vagy akár a másodperc töredékei. Ezért szó sincs makroszkopikus mennyiségű anyag felhalmozódásáról, az egyes atomokkal közvetlenül születésük után kell dolgoznunk.
Ez nem lenne nagy probléma, ha nem jön a második nehézség: ezek az atomok csakis beszerezhetők darabos mennyiségek. A szupernehéz atomok nukleáris reakciókban szintetizálódnak, két másik, meglehetősen nehéz, magas neutrontartalmú atom összeolvadásának folyamatában. Ennek érdekében az egyik típusú nehézionok sugarát egy másik típusú nehéz atomokat tartalmazó célpontra irányítják, és amikor ezek ütköznek, magreakciók lépnek fel. Az esetek túlnyomó többségében csak kisebb töredékeket hoznak létre, és csak elvétve fordul elő, hogy két mag összeolvadásakor születik meg a kívánt szupernehéz mag. Ennek eredményeként a szupernehéz magok képződési sebessége a célpont folyamatos besugárzása során nevetségesen alacsonynak bizonyul: percenként, óránként, naponta vagy akár hetente is.
Ez a születési technológia egy harmadik problémához vezet. A szupernehéz atomok szintézise a célt érő nyaláb állandó erős sugárzásának körülményei között megy végbe, és ennek következtében hatalmas mennyiségű idegen nukleáris törmelék jelenlétében. Még akkor is, ha a kívánt mag megszületik, elektronokat vesz fel a környezetből, valódi atommá válik, és végül közvetlenül a célpont mögött kémiai reakcióba lép, hogy új vegyület keletkezzen - ez a vegyület kemény sugárzási körülmények között lesz, állandó érintkezésben kemény ionizáció okozta plazmával Az a tény, hogy ilyen körülmények között általában a fleroviumig (114-es elem) lehet tanulmányozni a transzaktinoidok valamilyen kémiáját, önmagában nagy eredmény. Mostanáig azonban minden olyan kémiai vegyület, amely transzaktinoidokat tartalmaz, kémiai szempontból nagyon egyszerű volt – halogenidek, oxidok és más hasonló vegyületek, amelyek nehéz atomja a maximális oxidációs állapotban van. A nem triviális kémiai kötésekkel rendelkező, törékenyebb kémiai vegyületek gyorsan elpusztulnak erős sugárzás hatására. És mindez sajnos megnehezíti a transzaktinoidok kémiai tulajdonságainak tesztelését.
A minap egy magazinban Tudomány megjelent, ami a "nem triviális" transzaktinoidkémia kezdetét jelzi. Beszámol az Sg(CO) 6 vegyület, a seaborgium-hexakarbonil szintéziséről és kísérleti vizsgálatáról (2. ábra). Ezen túlmenően, ugyanabban az elrendezésben és ugyanazokkal a módszerekkel a seaborgium, Mo(CO) 6 és W(CO) 6 homológ elemek hexakarbonil komplexeit, valamint a molibdén és volfrám rövid élettartamú izotópjait is tanulmányozták, amelyek felezési ideje kb. néhány másodperc vagy perc.
Ennek a munkának a fő fénypontja egy olyan kombinált kísérleti elrendezés, amely az elmúlt évtized számos technikai vívmányát egyesíti. Ez a telepítés legyőzi a fent említett problémák harmadik részét - térben elválasztja a szupernehéz atommagok szintézisének területét és a kapott vegyület fizikai-kémiai kutatásának területét. Általános megjelenése az ábrán látható. 3. Az installáció bejáratánál (az ábra hátterében jobbról balra) egy magsugár kölcsönhatásba lép a célponttal, és másodlagos magokból „koktélt” generál. A reakciótermékeket dipólus mágneses tér (az ábrán D elem) téríti el, és az atommagok különböző töltés- és tömegarányaihoz eltérő módon. A mágneses tér nagyságát úgy számítjuk ki, hogy csak a vizsgált magok menjenek át a mágneses lencserendszeren (Q), míg a háttérmagok és az eredeti nyaláb eltérül. Lényegében ez a technika megismétli az atommagokra alkalmazott, jól ismert tömegspektrometriát.
A következő lépésben az elválasztott magok (Sg, Mo vagy W) belépnek az RTC kamrába, amelyen keresztül hélium és szén-monoxid gázkeveréket fújnak át. Fontos szempont: a kamrába vezető úton a magok egy szigorúan meghatározott vastagságú, mylarból készült ablakon haladnak át. Csillapítja a forró atommagok kinetikus energiáját, és lehetővé teszi számukra, hogy a gázkamrában termizáljanak (lelassuljanak a molekulák hőmozgásának energiájára). Ott az atommagok „elektronokkal vannak felöltözve”, és szén-monoxiddal kémiai reakcióba lépve vegyületet képeznek - karbonil-komplexet. Mivel a vegyület illékony, a teljes gázárammal egy 10 méteres teflon kapillárison keresztül a berendezés második részébe - egy speciális COMPACT analizátorba - kerül.
A COMPACT név azt jelenti Krio-Online multidetektor a transzaktinoidok fizikájához és kémiájához. Ez a telepítés 32 pár félvezető detektor egész sora instabil elemekből álló vegyületek gáztermokromatográfiájára. Erős hőmérsékleti gradiens jön létre a vonal mentén: minden detektorpár a saját hőmérsékletén van, a sor elején lévő +30°C-tól a végén -120°C-ig. Mindegyik detektor képes rögzíteni a bomlásuk során az atommagokból kibocsátott α és β részecskéket, és nagy pontossággal mérni azok energiáját és távozási idejét. Erre azért van szükség, hogy azonosítani lehessen a seaborgium magokat jellegzetes bomlási láncolatuk alapján, amelyben bizonyos energiájú alfa-részecskék egymás után szabadulnak fel, és ne keverjük össze ezeket a ritka eseményeket a háttérfolyamatokkal.
A COMPACT analizátor így működik. Amikor a gázelegyet átfújják a vonalzón, a nehézfém karbonil komplexének molekulái lerakódnak egy adott detektor felületére, ahol radioaktív bomlás után rögzítik őket. A detektor száma, amelyben a bomlást rögzítik, azt a hőmérsékletet jelzi, amelyen a molekula abszorpciója energetikailag kedvezővé válik. Ezt a hőmérsékletet a vizsgált karbonilkomplex fizikai-kémiai jellemzői – az adszorpciós entalpiája – határozzák meg. Nos, az anyagnak ezt a nagyon jellemző tulajdonságát pedig kémiai számítások jósolják meg, amelyben a relativisztikus hatások jelentős szerepet játszanak. Így az Sg(CO) 6, W(CO) 6 és Mo(CO) 6 COMPACT analizátorban történő lerakódásának mérésével igazolhatóak a kémiai elméleti számítások, és mérhető ezen anyagok adszorpciós entalpiája.

Ennek a vizsgálatnak az eredményei a ábrán láthatók. 4. Itt van néhány jellemző a 32 detektorpár mindegyikében. A felső grafikon egyszerűen a hőmérséklet eloszlása egy vonalzó mentén. A középső és alsó grafikonok valójában magukat a kísérleti adatokat mutatják – a wolfram-164 (középen) és seaborgium-265 (alul) atommagok rögzített bomlásának eloszlását a detektorok között. Természetesen itt nincs elég esemény seaborgiummal - a célpont két hetes folyamatos intenzív sugárral történő besugárzása során összesen 18-at rögzítettek. Ennek ellenére jól látható, hogy a 20-nál nagyobb számú detektorokban nem egyenletesen oszlanak el a vonal mentén, hanem közelebb a végéhez. Körülbelül ugyanezt a képet kaptuk, amikor ezt a folyamatot modelleztük az adszorpciós entalpiával, amelyet nemrég számítottak csak ezekre az anyagokra vonatkozó elméleti munka. Hasonló kép figyelhető meg az instabil wolfram izotóppal és molibdén izotópokkal rendelkező vegyületeknél is (az ábrán nem láthatók): az eloszlások maximuma pontosan oda esik, ahová az elméleti számítások jósolják. Ez az egybeesés további bizonyosságot ad afelől, hogy a nehéz atomok szerkezetének teljesen relativisztikus számításának modern módszerei megfelelően leírják a kísérleti adatokat.
Végül hasznos madártávlatból megvizsgálni ezt a kutatást. Jellemzően az instabil szupernehéz elemek érdekesek a fizikusok számára az új magfizikai ismeretek érdekében. Mivel azonban a természet lehetővé teszi számunkra, ezeket az elemeket más célra is fel lehet használni - annak tesztelésére, hogy mennyire tudunk előre jelezni kémiai Az ilyen atomok tulajdonságai. Erre az ismeretre viszont nem önmagában van szükségünk, hanem a nehézatomok elektronszerkezetének számítási elméletének, a relativisztikus hatások figyelembevételével a teljes modern elmélet további tesztjeként. Innen pedig számos alkalmazás következik, a tisztán alkalmazott kutatástól a valódi fundamentális tudományig. A transzaktinoidok kémiája ismét hangsúlyozza, hogy a fizika és a kapcsolódó tudományágak legkülönbözőbb területei milyen erősen kapcsolódnak egymáshoz.